Una mujer de 54 años de
edad con infección crónica por VIH fue admitida en el hospital por “dolor de
pecho y disnea”. Se observaron anormalidades en el electrocardiograma que se
anexa. Se realizó una prueba diagnóstica. El blog de Now@NEJM dispone de perlas
clínicas, acceso gratuito a este último caso del Hospital General de Massachusetts.
sábado, 29 de septiembre de 2012
ENFERMEDAD ARTERIAL PERIFÉRICA
Esta revisión ofrece un resumen actualizado de las nuevas evidencias relacionadas con la enfermedad vascular periférica, además de información para el diagnóstico, y tratamiento de los pacientes.
Dres. G Peach, M Griffin, K G Jones, M M Thompson, R J
BMJ 2012;345:e5208
Introducción
La enfermedad
arterial periférica (EAP) es un proceso aterosclerótico que provoca estenosis y
oclusión de las arterias, con exclusión de las cerebrales y las coronarias. La
prevalencia estimada en todo el mundo es de casi el 10%, alcanzando el 15-20%
en las personas >70 años; afecta a casi 27 millones de personas solo en
Europa y Norteamérica. Si la isquemia grave del miembro—la manifestación más
grave de la enfermedad—no es tratada prontamente puede provocar la pérdida del
miembro y aún la muerte. Se diagnostican unos 500-1.000 casos nuevos por millón
de habitantes cada año, lo que genera costos altísimos. Una mayor conciencia de
la enfermedad y el mejoramiento del tratamiento médico, como así las nuevas
intervenciones endovasculares han mejorado sustancialmente el tratamiento de
los pacientes con EAP.
¿Cuál es el riesgo?
El desarrollo de la
EAP aterosclerótica es un proceso multifactorial que comprende factores de
riesgo modificables e inmodificables. Aproximadamente el 65% de los
pacientes también tiene enfermedad arterial coronaria o cerebral importante; un
gran estudio prospectivo de cohorte mostró que los pacientes con EAP tienen 6
veces más riesgo de muerte por enfermedad cardiovascular que los pacientes sin
EAP. Por lo tanto, en esos pacientes es de suma importancia identificar y
tratar los factores de riesgo de enfermedad cardiovascular.
Edad, sexo y etnia
La incidencia y la
prevalencia de la EAP aumentan con la edad. Aunque algunos estudios han hallado
una prevalencia similar en ambos sexos, comúnmente la relación mujer:hombre de
la EAP es 2:1, y mayor aún (3:1) si hay isquemia grave del miembro. La raza
negra también es un factor de riesgo independiente de EAP, con un riesgo
relativo de 2,83.
Cigarrillo
El tabaquismo es el
factor de riesgo modificable más importante para el desarrollo de la EAP, y la
relación causal entre ambos puede ser aún más estrecha que entre el cigarrillo
y la enfermedad arterial coronaria. El trabajo Edinburgh Artery Study (1.592
participantes) comprobó que los fumadores tienen 4 veces más riesgo de
desarrollar claudicación intermitente que los no fumadores; también comprobó
que los pacientes con EAP que siguen fumando tienen mayor posibilidad de
requerir intervenciones o amputación, comparados con sus pares no fumadores.
Por otra parte, un metaanálisis reciente de 129 estudios halló que la tasa de
fracaso de los injertos de bypass es 3 veces mayor en los pacientes que siguen
fumando, aunque este efecto puede ser revertido al cesar de fumar.
Diabetes
La diabetes es un
factor de riesgo importante de EAP y de enfermedad cardiovascular más
generalizada; los pacientes con diabetes tienen 2 veces más probabilidad de
desarrollar EAP que los pacientes sin diabetes. Las arterias más afectadas en
aquellos pacientes son las infrapoplíteas, siendo de gran importancia el
control glucémico, como lo demostró un metaanálisis de 13 estudios que halló
que el 1% de aumento de la hemoglobina glicosilada (HbA1c) se asocia con un 26%
de riesgo de desarrollar EAP. La EAP también progresa con más rapidez en los
diabéticos, quienes tienen 5-10 veces más posibilidad de necesitar una
amputación mayor (por encima del tobillo) que los pacientes sin diabetes. Las
personas con diabetes y enfermedad renal terminal tienen un riesgo
particularmente elevado de perder el miembro.
La ulceración en
los diabéticos suele tener diversas etiologías, y aunque el 50% de los
pacientes diabéticos con úlceras en los pies tiene EAP, la neuropatía y la
infección suelen representar un papel importante. Los pacientes con diabetes y
ulceración en el pie tienen que ser evaluados cuanto antes (idealmente dentro
de las 24 horas) por un equipo multidisciplinario para la atención de pie
diabético.
Hipertensión e hiperlipidemia
Los datos del Framingham
Heart Study han mostrado que la hipertensión y la hiperlipidemia son
factores de riesgo independientes de EAP. Una presión arterial >160/95 mmHg
aumentó 2,5 veces el riesgo de claudicación intermitente en los hombres y 4
veces en las mujeres, mientras que una colesterolemia >269 mg/dl duplicó el
riesgo de claudicación.
Otros factores
La insuficiencia
renal crónica, el hematocrito elevado y las concentraciones elevadas de
homocisteína o fibrinógeno en el plasma también están relacionados con un
riesgo mayor de EAP, aunque no se sabe bien si esa relación es causal.
¿Como se presenta la enfermedad arterial periférica?
Los pacientes con
síntomas de EAP suelen presentar claudicación intermitente—dolor muscular que
aparece con el ejercicio y se alivia rápidamente con el reposo. A menudo, los
síntomas afectan el territorio de la arteria femoral superficial y el dolor se
presenta en la pantorrilla, la cual es distal a la estenosis y la oclusión
arterial. La enfermedad de las arterias ilíaca, femoral común o tibioperonea
puede causar dolor en las nalgas, el muslo o el pie, respectivamente. La
presencia de síntomas bilaterales puede indicar enfermedad aórtica,
enfermedad ilíaca bilateral o una causa no vascular.
La claudicación
aparece después de caminar una distancia sin dolor (a diferencia del dolor de
la artrosis) y empeora luego de caminar rápido o subir una cuesta, cuando los
requerimientos de oxígeno muscular son más elevados. Aunque la distancia a la
que el miembro claudica pueden ser un dato poco preciso para medir la gravedad
absoluta de la enfermedad, un cambio en la capacidad para caminar que se
presenta con el tiempo puede ser un indicador útil de la mejoría o el deterioro
clínico.
Los síntomas suelen
desarrollarse en meses o años, con una reducción gradual de la distancia
recorrida libre de dolor. La exacerbación rápida de los síntomas y el comienzo
súbito de la claudicación son signos de alarma porque pueden estar relacionados
con una oclusión arterial nueva. Esta oclusión está comúnmente causada por la
ruptura de una placa aterosclerótica o una trombosis arterial in situ (por ej.,
un trombo en un aneurisma poplíteo), pero también puede estar ocasionada por un
émbolo cardíaco o de las arterias más proximales.
Cuando los
pacientes con EAP experimentan una oclusión arterial aguda suelen presentar un
color oscuro y dolor en el miembro afectado. Esto contrasta con el cuadro
clásico de la isquemia aguda (dolor, palidez, ausencia de pulso, frialdad,
parestesia y parálisis) y es el resultado de la red extensa de arterias
colaterales que se desarrolla en las personas con EAP preexistente. Estos
pacientes requieren una derivación urgente al especialista.
La isquemia grave
del miembro se caracteriza por ulceración, gangrena o dolor en reposo que
permanece durante más de 2 semanas. El dolor en reposo verdadero afecta a los
dedos de los pies o al pie del miembro afectado (a diferencia de los calambres
nocturnos de la pantorrilla de carácter benigno) y los pacientes suelen relatar
que deben mantener el pie péndulo fuera de la cama para aliviar los síntomas.
¿Cuál es la evolución natural de la enfermedad arterial periférica?
Aunque muchos
pacientes nunca experimentan síntomas, el 7-15% de las personas con EAP
asintomática sufrirá claudicación intermitente dentro de los 5 años. De
aquellos que desarrollan claudicación, solo el 20-25% puede llegar a sufrir un
deterioro clínico. La amputación mayor es rara (excepto en los diabéticos) y
los pacientes deben ser tranquilizados al respecto—solo el 1-3% de los
pacientes con claudicación intermitente requerirá una amputación mayor en un
período de 5 años.
Aunque algunos
pacientes siguen una progresión gradual de la EAP asintomática hacia la
claudicación intermitente y luego a la isquemia grave del miembro, esta
evolución es más la excepción que la regla, y más de la mitad de los que son
sometidos a una amputación mayor por isquemia grave del miembro puede no haber
tenido síntomas de isquemia hasta 6 meses antes. Por otra parte, es frecuente
que los pacientes con EAP tengan comorbilidades importantes que limitan su
actividad y por lo tanto pueden tener una isquemia grave del miembro sin haber
presentado claudicación intermitente. Los que presentan isquemia grave del
miembro establecida tienen mal pronóstico. Aproximadamente el 12% de estos
pacientes requiere una amputación mayor dentro de los 3 meses de la
presentación mientras que el 20-25% mueren dentro del año. La tasa de
supervivencia estimada a los 5 años de los pacientes con isquemia grave del
miembro es 50-60% (peor que la de muchos cánceres), de modo que estos pacientes
necesitan ser derivados con urgencia al especialista.
¿Cómo se evalúan los síntomas de la enfermedad arterial periférica?
Una vez que se
sospecha el diagnóstico de EAP se deberá hacer un examen cardiovascular
completo para identificar otras manifestaciones de la enfermedad
cardiovascular. Se evaluarán la temperatura del miembro y el tiempo del relleno
capilar, además del examen cuidadoso de los pies para detectar signos de
pérdida de tejido (ulceración o necrosis). También es importante buscar signos
más sutiles de isquemia, como la palidez al elevar el miembro y la hiperemia
cuando la pierna está péndula (singo de Buerger). Estos signos están causados
por la pérdida de la autorregulación capilar del miembro isquémico.
La palpación de los
pulsos periféricos ayuda a localizar el sitio de la estenosis o de la oclusión
e identificar a otras enfermedades, como los aneurismas poplíteos. Si la
presencia de pulsos es dudosa, se puede medir el índice de presión
tobillo-brazo, con la ayuda de un equipo Doppler. Sin embargo, en los
diabéticos, la interpretación de los resultados debe ser muy cuidadosa ya que las
calcificaciones arteriales pueden crear artificialmente una mayor presión en el
tobillo. Varias enfermedades pueden presentarse con síntomas similares a los de
la EAP, siendo la más común la enfermedad de la médula lumbar (causante de
claudicación medular) la que puede distinguirse de la EAP por la presencia de
debilidad y dolor al caminar. La elevación de la pierna en posición recta
también puede provocar síntomas en estos pacientes.
Diagnóstico diferencial
No vasculares: condiciones comunes
Dolor aliviado por la flexión lumbar (sentado) Enfermedad degenerativa de la columna lumbar Estenosis del canal espinal (a menudo asociada con debilidad en las piernas) Irritación de la raíz nerviosa lumbar (puede ser exacerbada por la elevación de pierna estirada)
Dolor provocado en la exploración articular
Artrosis de cadera o rodilla
Vascular (no aterosclerótico): enfermedades raras
Paciente atlético: Atrapamiento de la arteria poplítea; endofibrosis arteria ilíaca Enfermedad de grandes fumadores: enfermedad de Buerger (tromboangiitis obliterante) Pacientes jóvenes sin factores de riesgo: enfermedad adventicia quística Tumor doloroso o pulsátil en la nalga(s): arteria ciática persistente |
¿Cuáles son los pacientes que deben derivarse al cirujano vascular?
Todos los pacientes
con claudicación intermitente deben ser derivados al especialista, en
particular si el diagnóstico de EAP es incierto. Aunque el manejo de la mayoría
de los pacientes no incluirá un tratamiento de revascularización, es importante
la evaluación del especialista para identificar a los que pueden beneficiarse
con dicha intervención.
Los pacientes con
signos de pérdida de tejido o comienzo súbito o deterioro de los síntomas deben
ser derivados con urgencia al especialista para su evaluación. La guía de NICE
recomienda que los pacientes diabéticos con ulceración en el pie de reciente
comienzo deben ser evaluados por un equipo multidisciplinario para la atención
del pie diabético, dentro de las 24 horas de su presentación, porque tales
úlceras pueden progresar rápidamente a una infección y la posterior indicación
de amputación. Los únicos pacientes para quienes la derivación al especialista
puede ser innecesaria son los que tienen sospecha de EAP pero que solo sufren
una claudicación leve que no afecta su calidad de vida (debido a que tales
pacientes no serían candidatos para la revascularización).
¿Cómo se continúa la evaluación de los pacientes?
Los centros
especializados pueden complementar la medición del índice de presión
tobillo-brazo mediante la medición del índice de presión dedo del pie-brazo, la
medición transcutánea del oxígeno o la prueba del ejercicio. Una vez
establecido el diagnóstico, muchos pacientes no requerirán un estudio por
imagen porque en ellos la revascularización ofrece poco beneficio. En caso de
ser necesarias las imágenes, el estudio de primera elección es la ecografía
Doppler porque no es invasiva, es de fácil acceso y posee una sensibilidad del
84-87% con una especificidad del 92-98%, comparada con la angiografía.
El estudio de
elección siempre fue la angiografía por sustracción digital, considerada como
el “estándar de oro” para la evaluación detallada de las arterias comprometidas
por la EAP, pero ha sido superada por la angiografía por tomografía
computarizada y por la angiografía por resonancia magnética, por su elevada
sensibilidad y especificidad y su carácter no invasivo. La angiografía por
sustracción digital representa un papel muy importante en la cirugía de
revascularización.
¿Cómo se puede manejar la enfermedad arterial periférica en atención
primaria?
En todos los
pacientes con sospecha de EAP se debe investigar la presencia de factores de
riesgo cardiovasculares.
Paraclinicos recomendados
- Para todos los pacientes
Glicemia al azar (para excluir diabetes oculta) Hemoglobina glicosiladada (para valorar el control glicémico en los pacientes diabéticos) Hemograma completo (para excluir la policitemia, la anemia y la trombocitopenia ) Uremia y creatininemia (para excluir la disfunción renal) Colesterolemia
- Para los pacientes <50 años
Cribado de trombofilia Homocisteína sérica |
çModificación de los factores de riesgo
Los factores de
riesgo deben ser modificados con el fin de reducir los cuadros cardiovasculares
con peligro de muerte y evitar la progresión de la EAP. La cesasión de fumar es
extremadamente importante como así el control de la hipercolesterolemia y la hipertensión
arterial. Los pacientes con un índice de masa corporal >25 también deben
recibir el consejo de adelgazar y hacer ejercicios en forma regular. El
análisis de subgrupo indicó que los inhibidores de la enzima convertidora de
angiotensina reducen el riesgo de cuadros cardiovasculares en los pacientes con
EAP, y son considerados agentes de primera elección para el tratamiento de la
hipertensión. Sin embargo, hay que hacer un control estricto ya que más del 25%
de los pacientes con EAP también tiene estenosis de la arteria renal. Un
metaanálisis de 11 estudios aleatorizados y controlados ha mostrado que los
bloqueantes β no solo son seguros para el tratamiento de los pacientes con EAP
sino que también pueden reducir los cuadros cardiovasculares perioperatorios.
Para prevenir la
progresión de la EAP y reducir el riesgo cardiovascular global están indicados
los antiplaquetarios. Un análisis de subgrupo del estudio CAPRIE (un gran
estudio aleatorizado y controlado de 19.185 pacientes con todas las formas de enfermedad
cardiovascular) halló que el clopidogrel es más eficiente que la aspirina, con
una reducción del riesgo relativo de infarto de miocardio, accidente
cerebrovascular y muerte vascular del 8,7%. Debido a que posee un perfil de
seguridad que supera al de la aspirina y su costo en el Reino Unido es
comparable, NICE recomienda su uso como antiplaquetario de primera línea para
los pacientes con EAP.
En general, para
los pacientes con EAP no se recomienda el uso concomitante de más de un agente
antiplaquetario, pero dicha asociación puede ser útil para aquellos que tienen
bypass protésicos. No se recomienda e tratamiento rutinario con warfarina para
los pacientes con EAP a menos que tengan otra indicación para su uso.
Conducta ante los síntomas de claudicación
Ejercicio
Ejercicio
Una revisión de
Cochrane de 22 estudios de 1.200 participantes concluyó que en los pacientes
con claudicación, el ejercicio con 2 sesiones semanales como mínimo puede
mejorar la distancia recorrida sin dolor en un 50-200%. Otro metaanálisis de Cochrane
confirmó que los programas de ejercicios estructurados brindan un beneficio
mayor, y que los pacientes que siguen un programa supervisado muestran un
30-35% más de mejoría de la distancia recorrida, al cabo de 3 meses. Por lo
tanto, NICE recomienda que todos los pacientes con claudicación intermitente
entren en un programa de ejercicios supervisados.
Fármacos vasoactivos
En la actualidad,
en el Reino Unido hay 2 fármacos disponibles para el tratamiento de la
claudicación intermitente: el cilostazol y el naftidrofurilo oxalato. Un
metaanálisis de 26 estudios que evaluaron la eficacia de esos fármacos halló
que ambos ofrecen poca mejoría de la distancia recorrida con efectos adversos
mínimos. Sin embargo, hay poco datos de seguimiento más allá de los 6
meses y la relación costo efectividad es cuestionable. Como resultado, la guía
nueva de NICE recomienda el naftidrofurilo solo para el tratamiento de los
pacientes con EAP y sugiere su uso para aquellos que no han mejorado con un
programa de ejercicios estructurado y no desean someterse a la angioplastia o
la cirugía. El tratamiento con naftidrofurilo puede iniciarse en atención
primaria, pero debe ser supervisado cada 3-6 meses y suspendido cuando los
síntomas mejoran. Aunque los agentes antiplaquetarios y vasodilatadores (como
la nifedipina) pueden ser útiles para reducir el riesgo cardiovascular general,
hay poca evidencia de que brinden algún beneficio en el tratamiento de los
síntomas de claudicación.
¿Cuáles son los principios para el manejo posterior de la enfermedad
arterial periférica?
Cuando las medidas
conservadoras han fallado y la EAP está afectando gravemente el estilo de vida
del paciente o ha comenzado a poner en peligro el miembro afectado se deberá
considerar la intervención, la cual puede ser endovascular (angioplastia o
colocación de un stent) o quirúrgica. Aunque el tratamiento endovascular estaba
originalmente reservado para las estenosis focales cortas, los avances en el
equipamiento y las técnicas han permitido el tratamiento de una mayor
proporción de lesiones.
Intervención para la claudicación intermitente
En los pacientes
con claudicación intermitente, la enfermedad suele estar limitada a un solo
segmento arterial, el cual puede ser tratado mediante la terapia endovascular.
Los pacientes con enfermedad ilíaca focal pueden beneficiarse más del
tratamiento endovascular que los pacientes con enfermedad de la arteria
femoral, porque la intervención en la arteria ilíaca ofrece resultados más
duraderos. Un metaanálisis ha mostrado que la permeabilidad a los 5 años
después de la angioplastia ilíaca es 79% mientras que la de la angioplastia
femoral es del 55%. Sin embargo, hay cierta evidencia de que los programas de
ejercicios estructurados pueden mejorar la distancia recorrida tanto como
la angioplastia. En general, el bypass quirúrgico se reserva para los pacientes
con claudicación debilitante y un patrón de enfermedad que no es apto para la
angioplastia.
Intervención para la isquemia grave del miembro
En los pacientes
con isquemia grave del miembro, la enfermedad suele estar localizada en
diferentes niveles y por lo tanto, lo más apropiado es el bypass quirúrgico,
aunque las técnicas endovasculares son cada vez más usadas como un complemento
para mejorar el flujo en los vasos proximales o distales al bypass. Por lo
tanto, la tecnología emergente como los balones y los stents liberadores de
fármaco puede mejorar la eficacia de las técnicas endovasculares.
En la actualidad,
la guía Trans-Atlantic Inter-Society Consensus for the Management of
Peripheral Arterial Disease (TASC II) recomienda que los pacientes con
enfermedad aortoilíaca difusa sean tratados con bypass quirúrgico (a menos que
existan otros factores que lo impidan, como ciertas comorbilidades); en los
pacientes con isquemia grave del miembro, la permeabilidad a los 5 años de
dicha intervención es > 85%. Aunque pocos estudios han comparado
directamente la angioplastia y el bypass quirúrgico, el estudio UK
Bypass versus Angioplasty in Severe Ischaemia of the Leg comparó los
resultados en 452 pacientes con enfermedad femoropoplítea e isquemia grave del
miembro. Este estudio no halló diferencia entre la angioplastia y el bypass en
términos de supervivencia sin necesidad de amputación, mortalidad global o
calidad de vida a los 2 años, aunque el grupo de angioplastia mostró tasas
significativamente más elevadas de reintervención (28% vs. 17%) y finalmente,
más necesidad de tratamiento quirúrgico. El análisis posterior de subgrupo
indicó que la cirugía puede ser el tratamiento de primera elección. Para el
bypass quirúrgico, y siempre que sea posible se utiliza el tejido venoso,
porque las tasas de permeabilidad a los 5 años son mucho mayores que con los
injertos protésicos (70% vs. 20% para le bypass femorodistal).
Actualmente existen
algunas pruebas de que la angioplastia sola puede beneficiar a los pacientes
con isquemia grave del miembro y enfermedad infrainguinal que no están en
condiciones físicas de ser sometidos a un bypass quirúrgico. Aunque la
permeabilidad a largo plazo es escasa, la mejoría de la perfusión distal en el
corto plazo puede ser suficiente como para permitir la curación de las úlceras.
Cuando se considera que la revascularización no va a ser útil o que los
pacientes tienen comorbilidades que podrían impedir el salvataje del miembro,
la amputación primaria puede ofrecer una calidad de vida mejor. Siempre que sea
posible se debe preservar la articulación de la rodilla con el fin de conservar
la movilidad, aunque esto puede estar contrarrestado por la necesidad de
asegurar la cicatrización de la herida.
¿Cuáles son las opciones terapéuticas no quirúrgicas para la isquemia
grave del miembro?
Se considera que
los tratamientos no quirúrgicos como los prostanoides (por ej., el iloprost),
la estimulación medular y la simpaticectomía lumbar brindan pocos beneficios a
largo plazo, de manera que para los pacientes que no son aptos físicamente para
la intervención de revascularización es aconsejable el manejo de los síntomas y
la amputación.
Consejos para no especialistas
• La enfermedad de la columna lumbar puede causar síntomas similares
a los de la enfermedad arterial periférica.
• Cuando atiende a un paciente joven con claudicación se recomienda consultar a un especialista, ya que puede no tener enfermedad vascular aterosclerótica (por ej., síndrome de atrapamiento poplíteo o endofibrosis ilíaca). • Algunos pacientes con claudicación que no mejoran con medidas conservadoras pueden beneficiarse con la angioplastia. • La mayoría de los pacientes con isquemia grave del miembro son tratados con bypass quirúrgico, pero cada vez se utiliza más la angioplastia. • Las úlceras del pie tienen múltiples causas en los diabéticos, quienes deben ser atendidos por un equipo multidisciplinario especializado en pie diabético, dentro de las 24 horas. • Un índice de presión tobillo braquial <0,9 se asocia con un umbral 6 veces mayor de muerte por enfermedad cardiovascular. |
Investigaciones en curso y objetivos futuros
Los balones y stents liberadores de fármacos pueden llegar a ser
superiores a los stents de metal desnudo para el tratamiento de la EAP,
especialmente
en los vasos infrapoplíteos, donde las tasas de reestenosis son elevadas. Sin embargo, estos dispositivos son caros y con poca evidencia clínica de ventaja, requiriéndose ensayos adicionales.
Varios estudios muy pequeños han demostrado que la inyección de
factores de crecimiento angiogénico en el músculo gastrocnemio puede
estimular la angiogénesis, inducir el crecimiento de vasos sanguíneos nuevos
y reducir la claudicación y la pérdida de tejido. Sin embargo, se necesitan
más estudios antes de que estos tratamientos estén disponibles para el uso
clínico de rutina.
|
miércoles, 26 de septiembre de 2012
Resolución del caso 1
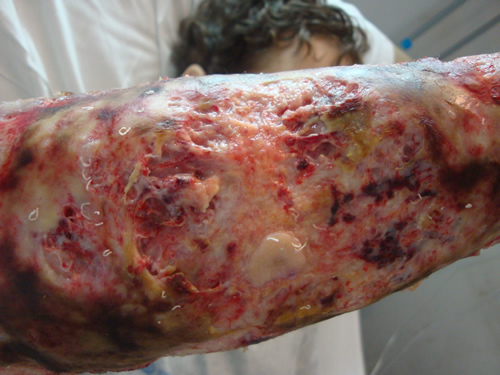
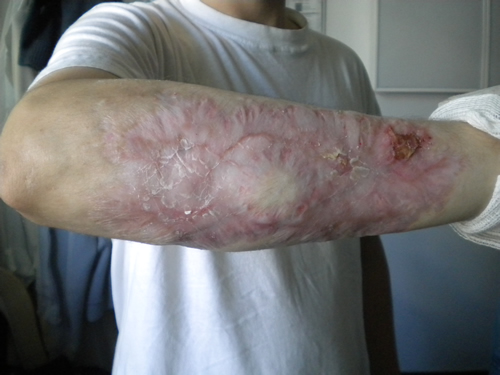
Los cultivos
microbiológicos (hemocultivos periféricos y cultivo de lesión cutánea)
resultaron negativos. La biopsia cutánea informó una lesión con infiltrado
inflamatorio agudo, con ulceración y necrobiosis, con infiltrado neutrofílico.
Teniendo en cuenta el antecedente de colitis ulcerosa, se arriba al diagnóstico
de pioderma gangrenoso, por lo que se inicia tratamiento con corticoides
(prednisona 1mg/kg/día) y curas húmedas con vaselina estéril. Tras una
evolución inicial favorable, se decide el alta hospitalaria. Luego de dos meses
de tratamiento esteroideo con disminución gradual de la dosis, se inicia
tratamiento con azatioprina. En controles posteriores, tras nueve meses de
iniciado el tratamiento, se constató una resolución completa de la lesión,
quedando como secuela tejido cicatrizal.
Revisión: Pioderma Gangrenoso
El pioderma gangrenoso (PG) es
una rara condición inflamatoria cutánea, de etiología desconocida, que
pertenece al espectro de las dermatosis neutrofílicas. Clásicamente se
caracteriza por un nódulo o pústula dolorosa que se ulcera de manera precoz y
presenta un agrandamiento progresivo.
Puede presentarse en cualquier grupo etáreo, pero es más frecuente entre los 20
y 50 años con un leve predominio femenino.
Aunque la enfermedad es idiopática en el 25 a 50 % de los casos, existen
procesos sistémicos que pueden asociarse, principalmente enfermedad
inflamatoria intestinal y artritis reumatoidea. (Tabla 1)
Fisiopatología
El mecanismo desencadenante del PG se desconoce, pero su asociación con ciertos
procesos autoinmunes, como así también la respuesta a agentes
inmunomoduladores, sugiere la existencia de un componente inmunológico. Por
otra parte, su vinculación con el fenómeno de patergia, que corresponde al
desarrollo de nuevas lesiones o a la agravación de lesiones preexistentes tras
traumas comunes, sugiere la presencia de una respuesta inflamatoria alterada,
exagerada e incontrolada ante estímulos inespecíficos.
Las células predominantes en la histología del PG son los neutrófilos, por lo
que se piensa que una disfunción de éstos (quimiotaxis, hiperreactividad),
sería la responsable de su patogénesis.
Se ha detectado un factor leucocitario que aumenta la migración de los
leucocitos sin modificar su actividad quimiotáctica. Se comunicaron también
hallazgos aislados de cambios en la activación de la función antimicrobiana de
los leucocitos y de las funciones de los neutrófilos asociados con
hipergammaglobulinemia IgE. Las inmunoglobulinas circulantes afectan la función
del neutrófilo y, a menudo, se detecta una hipergammaglobulinemia monoclonal o
policlonal.
Clasificación
Existen cuatro formas principales de PG (Tabla 2).
Presentación
clínica
Aunque puede localizarse en cualquier parte de la anatomía, el PG ocurre más
comúnmente en las piernas, con preferencia por la zona pretibial. Las úlceras
comienzan como una pústula folicular con rápido crecimiento y áreas de
necrosis. Sus bordes suelen ser sobreelevados de coloración azul-violácea,
serpinginosos, rodeados de un halo eritematoso y edema. Generalmente son muy
dolorosas, incluso puede existir dolor desproporcionado al área afectada.
Aproximadamente un 50% de los pacientes muestran una enfermedad sistémica
subyacente, siendo la colitis ulcerosa la más frecuentemente implicada,
observándose en un 10 a 15% de los casos. Por otra parte, el 3% de los
pacientes con colitis ulcerosa presentará PG a lo largo de la enfermedad,
pudiendo ser la primera manifestación de ésta.
Diagnóstico:
No existe un examen analítico o histopatológico específico para arribar al
diagnóstico de PG, sino que éste es de exclusión. Se han propuesto criterios
diagnósticos, pero no han sido validados (Tabla 3).
1-Característicamente se extiende 1 o 2 cm por día o el 50 % en
una semana
2-Dolor desproporcionado al área de afectación
3-Típicamente se inicia como un nódulo, pápula o bulla
4- Enfermedad inflamatoria intestinal, poliartritis, leucemia mielocítica, preleucemia, etc.
5- Generalmente disminuye el 50% posterior a un mes de corticoterapia
2-Dolor desproporcionado al área de afectación
3-Típicamente se inicia como un nódulo, pápula o bulla
4- Enfermedad inflamatoria intestinal, poliartritis, leucemia mielocítica, preleucemia, etc.
5- Generalmente disminuye el 50% posterior a un mes de corticoterapia
La realización de una biopsia de
la lesión presenta crucial importancia para descartar otras entidades. Debe
realizarse cultivo microbiológico para bacterias, micobacterias y hongos.
Diagnóstico Diferencial:
1. Vasculitis
• Poliarteritis Nodosa
• Crioglobulinemia Mixta (asociado a infección por virus de hepatitis C - VHC)
2. Condiciones trombofílicas
• Síndrome antifosfolipídico
• Mutación del factor V de Leiden
3. Neoplasias
• Carcinoma de células escamosas
• Linfoma Cutáneo
• Leucemia Cutis
• Carcinoma Metastásico
4. Infecciones
• Micobacterias
• Hongos
• Leishmaniasis cutánea
• Lesiones herpéticas crónicas
Tratamiento
Los objetivos de la terapia incluyen detener la progresión de las úlceras,
promover la reepitelización, reducir el dolor y minimizar las secuelas.
El tratamiento sistémico de primera línea lo constituyen los corticoesteroides
a dosis altas (prednisona 1 mg/kg/día o sus equivalentes). En los casos
refractarios, los fármacos inmunosupresores (Ciclosporina A, Azatioprina,
Dapsona) han resultado efectivos y junto con los nuevos agentes biológicos
(principalmente drogas anti-TNF) constituyen opciones de segunda y tercera
línea.
La terapia tópica usualmente es inefectiva sin tratamiento sistémico; sin
embargo, es necesaria para mejorar el autodebridamiento, reducir el exudado,
prevenir infecciones, mejorar la granulación y la reepitalización, reducir el
dolor y proteger el tejido periférico. Las medidas locales como apósitos,
elevación del miembro, reposo y agentes tópicos pueden ser beneficiosas. Los
ungüento de corticoides o tacrolimus y las inyecciones intralesionales de
corticoides y ciclosporina deben considerarse la primera línea de tratamiento
en casos seleccionados de PG, especialmente cuando el tratamiento
inmunosupresor sistémico está contraindicado debido a otras razones (HIV, VHC).
Otras opciones son el diacetato de triamcinolona, peróxido de benzoílo, oxígeno
hiperbárico, cromoglicato disódico, entre otras.
Debido al fenómeno de patergia
debe indicarse con precaución la resolución quirúrgica, y siendo utilizada
únicamente como adyuvante a la terapia inmunosupresora en casos con enfermedad
estable o en remisión parcial. Algunos casos se han beneficiado de un injerto
autólogo de piel, sobre todo en las mamas, aunque no hay que olvidar el riesgo
de aparición de una nueva lesión de PG en la zona donante. Hoy se están
utilizando injertos de piel procesados por bioingeniería, que evitan maniobras
quirúrgicas capaces de desencadenar un fenómeno de patergia.
Pronóstico
Muchos pacientes presentan un único episodio de PG o episodios repetidos con
intervalos prolongados de tiempo entre ellos. En cambio, otros presentan un
curso crónico o recurrente, requiriendo tratamiento a largo plazo con terapias
más complejas y combinadas, aumentando el riesgo de toxicidad y efectos
adversos. Sin embargo, el pronóstico a largo plazo para la mayoría de los
pacientes es bueno, principalmente para aquellos que no presentan una
enfermedad asociada.
domingo, 23 de septiembre de 2012
PROFILAXIS DEL TROMBOEMBOLISMO VENOSO EN PACIENTES HOSPITALIZADOS Las siguientes son las recomendaciones del American College of Physicians para la profilaxis de la tromboembolia venosa en pacientes hospitalizados.
 Introducción
IntroducciónLa tromboembolia venosa (TEV), comprende la embolia pulmonar y la trombosis venosa profunda y constituye una complicación frecuente en el ámbito hospitalario, de acuerdo a los siguientes datos:
• La mayoría de los pacientes hospitalizados tienen al menos un factor de riesgo de TEV que persiste durante varias semanas después del alta;
• El 26% de los pacientes con embolia pulmonar no diagnosticada y sin tratamiento puede sufrir un nuevo episodio embólico mortal;
• Otro 26% sufrirá un nuevo episodio embólico no mortal;
• Entre el 5% y el 10% de las muertes hospitalarias son consecuencia de embolia pulmonar.
El objetivo de este trabajo es presentar recomendaciones clínicas sobre la prevención de la TEV en pacientes adultos no quirúrgicos hospitalizados y en pacientes con accidente cerebrovascular (ACV) agudo.
Métodos
Se llevó a cabo una revisión sistemática en las bases de datos MEDLINE y COCHRANE de estudios clínicos sobre la profilaxis de la TEV. Todos los estudios fueron aleatorizados y el criterio principal de valoración fue la mortalidad total durante los primeros 120 días posteriores a la aleatorización. Los criterios de valoración secundarios fueron: trombosis venosa profunda sintomática, todos los casos de embolia pulmonar, la embolia pulmonar mortal, todos los episodios de hemorragia y los episodios de hemorragia grave.
Se llevó a cabo una revisión sistemática en las bases de datos MEDLINE y COCHRANE de estudios clínicos sobre la profilaxis de la TEV. Todos los estudios fueron aleatorizados y el criterio principal de valoración fue la mortalidad total durante los primeros 120 días posteriores a la aleatorización. Los criterios de valoración secundarios fueron: trombosis venosa profunda sintomática, todos los casos de embolia pulmonar, la embolia pulmonar mortal, todos los episodios de hemorragia y los episodios de hemorragia grave.
Beneficios y desventajas de la profilaxis con heparina
Pacientes no quirúrgicos: Se analizaron 10 estudios que totalizaron 20717 pacientes no quirúrgicos sin ACV con las siguientes conclusiones al comparar la administración de heparina versus la ausencia de administración:
La administración de heparina:
• Disminuyó la mortalidad, aunque sin alcanzar significación estadística.
• Disminuyó el riesgo de embolia pulmonar.
• Aumentó el riesgo de hemorragia, pero no hubo diferencia significativa en la tasa de hemorragias graves.
• Redujo la tasa de trombosis venosa profunda, aunque sin alcanzar significación estadística.
Pacientes con ACV agudo. Se analizaron 10 estudios, con un total de 15405 pacientes con ACV agudo y la conclusión fue que la administración de heparina en estos pacientes no redujo en forma significativa la mortalidad o la tasa de TVP sintomática, pero aumentó significativamente la tasa de hemorragias.
Pacientes no quirúrgicos: Se analizaron 10 estudios que totalizaron 20717 pacientes no quirúrgicos sin ACV con las siguientes conclusiones al comparar la administración de heparina versus la ausencia de administración:
La administración de heparina:
• Disminuyó la mortalidad, aunque sin alcanzar significación estadística.
• Disminuyó el riesgo de embolia pulmonar.
• Aumentó el riesgo de hemorragia, pero no hubo diferencia significativa en la tasa de hemorragias graves.
• Redujo la tasa de trombosis venosa profunda, aunque sin alcanzar significación estadística.
Pacientes con ACV agudo. Se analizaron 10 estudios, con un total de 15405 pacientes con ACV agudo y la conclusión fue que la administración de heparina en estos pacientes no redujo en forma significativa la mortalidad o la tasa de TVP sintomática, pero aumentó significativamente la tasa de hemorragias.
Eficacia comparativa de la heparina de bajo peso molecular
versus la heparina no fraccionada
Pacientes clínicos Se analizaron 9 estudios que totalizaron 11650 pacientes con los siguientes resultados:
• No se observó diferencia significativa en la mortalidad entre ambos grupos.
• No se observó diferencia significativa en la tasa de hemorragias entre ambos grupos.
• No se observó diferencia significativa en la tasa de embolia pulmonar entre ambos grupos, aunque hubo una tendencia favorable en los pacientes que recibieron heparina de bajo peso molecular.
Pacientes con ACV agudo Se analizaron cinco estudios con un total de 2785 pacientes con ACV agudo. No hubo diferencias significativas entre ambos grupos en la mortalidad, la tasa de trombosis venosa profunda, de embolia pulmonar y de hemorragias.
Pacientes clínicos Se analizaron 9 estudios que totalizaron 11650 pacientes con los siguientes resultados:
• No se observó diferencia significativa en la mortalidad entre ambos grupos.
• No se observó diferencia significativa en la tasa de hemorragias entre ambos grupos.
• No se observó diferencia significativa en la tasa de embolia pulmonar entre ambos grupos, aunque hubo una tendencia favorable en los pacientes que recibieron heparina de bajo peso molecular.
Pacientes con ACV agudo Se analizaron cinco estudios con un total de 2785 pacientes con ACV agudo. No hubo diferencias significativas entre ambos grupos en la mortalidad, la tasa de trombosis venosa profunda, de embolia pulmonar y de hemorragias.
Eficacia de los dispositivos mecánicos en relación con los
no mecánicos
La evidencia proveniente de estudios aleatorizados, controlados, que evaluaron los dispositivos mecánicos versus los no mecánicos es escasa.
• Un estudio de 2518 pacientes con ACV no encontró diferencias entre el empleo y la ausencia de empleo de medias elásticas de compresión graduada sobre el riesgo de mortalidad, la embolia pulmonar y la trombosis venosa profunda;
• Se observó aumento significativo de lesiones en la piel con el empleo de las medias de compresión graduada;
• Un estudio mostró que las medias compresivas por debajo de la rodilla aumentaron el riesgo de trombosis venosa profunda en el muslo, mientras que esta complicación no se observó con las medias compresivas que cubrían toda la extensión del miembro inferior;
•Se realizó un estudio sobre 2085 pacientes hospitalizados inmovilizados que recibieron enoxaparina durante 10 días y seguidamente fueron divididos en un grupo que recibió enoxaparina durante otros 28 días y un grupo que recibió placebo. En el grupo que recibió enoxaparina adicional, el riesgo de trombosis venosa profunda sintomática se redujo en forma significativa.
La evidencia proveniente de estudios aleatorizados, controlados, que evaluaron los dispositivos mecánicos versus los no mecánicos es escasa.
• Un estudio de 2518 pacientes con ACV no encontró diferencias entre el empleo y la ausencia de empleo de medias elásticas de compresión graduada sobre el riesgo de mortalidad, la embolia pulmonar y la trombosis venosa profunda;
• Se observó aumento significativo de lesiones en la piel con el empleo de las medias de compresión graduada;
• Un estudio mostró que las medias compresivas por debajo de la rodilla aumentaron el riesgo de trombosis venosa profunda en el muslo, mientras que esta complicación no se observó con las medias compresivas que cubrían toda la extensión del miembro inferior;
•Se realizó un estudio sobre 2085 pacientes hospitalizados inmovilizados que recibieron enoxaparina durante 10 días y seguidamente fueron divididos en un grupo que recibió enoxaparina durante otros 28 días y un grupo que recibió placebo. En el grupo que recibió enoxaparina adicional, el riesgo de trombosis venosa profunda sintomática se redujo en forma significativa.
Recomendaciones del American
College of Physicians
►Primera recomendación
Evaluar el riesgo de TEV y de hemorragia en los pacientes clínicos, incluido el ACV, antes de iniciar la profilaxis (recomendación fuerte, evidencia moderada).
La decisión de iniciar la profilaxis de la TEV en pacientes clínicos se debe basar sobre la evaluación personalizada del riesgo de tromboembolia y hemorragia, así como la determinación de los posibles daños vs beneficios modestos o ningún beneficio.
Los factores de riesgo de TEV son: trastornos hereditarios de la coagulación (mutación del factor V de Leiden, mutación del gen de protrombina, deficiencia de proteína S, de proteína C o de antitrombina) y trastornos adquiridos: cirugía, cáncer, inmovilización, traumatismo, catéteres venosos centrales, embarazo y fármacos (anticonceptivos, tratamiento de reemplazo hormonal, tamoxifeno).
►Segunda recomendación
Realizar profilaxis farmacológica con heparina o fármaco relacionado en los pacientes clínicos, incluido el ACV, a menos que el riesgo de hemorragia supere el posible beneficio (recomendación fuerte, evidencia moderada).
En la mayoría de los pacientes, el beneficio clínico de la disminución de la embolia pulmonar supera la desventaja del aumento del riesgo de hemorragia.
La duración óptima de la profilaxis con heparina es incierta.
►Tercera recomendación
No se recomienda la profilaxis con medias de compresión graduada (recomendación fuerte, evidencia moderada).La profilaxis mecánica con medias elásticas de compresión graduada no fue eficaz para prevenir la TEV o reducir la mortalidad y produjo daño importante en la piel de las extremidades inferiores.
►Primera recomendación
Evaluar el riesgo de TEV y de hemorragia en los pacientes clínicos, incluido el ACV, antes de iniciar la profilaxis (recomendación fuerte, evidencia moderada).
La decisión de iniciar la profilaxis de la TEV en pacientes clínicos se debe basar sobre la evaluación personalizada del riesgo de tromboembolia y hemorragia, así como la determinación de los posibles daños vs beneficios modestos o ningún beneficio.
Los factores de riesgo de TEV son: trastornos hereditarios de la coagulación (mutación del factor V de Leiden, mutación del gen de protrombina, deficiencia de proteína S, de proteína C o de antitrombina) y trastornos adquiridos: cirugía, cáncer, inmovilización, traumatismo, catéteres venosos centrales, embarazo y fármacos (anticonceptivos, tratamiento de reemplazo hormonal, tamoxifeno).
►Segunda recomendación
Realizar profilaxis farmacológica con heparina o fármaco relacionado en los pacientes clínicos, incluido el ACV, a menos que el riesgo de hemorragia supere el posible beneficio (recomendación fuerte, evidencia moderada).
En la mayoría de los pacientes, el beneficio clínico de la disminución de la embolia pulmonar supera la desventaja del aumento del riesgo de hemorragia.
La duración óptima de la profilaxis con heparina es incierta.
►Tercera recomendación
No se recomienda la profilaxis con medias de compresión graduada (recomendación fuerte, evidencia moderada).La profilaxis mecánica con medias elásticas de compresión graduada no fue eficaz para prevenir la TEV o reducir la mortalidad y produjo daño importante en la piel de las extremidades inferiores.
viernes, 21 de septiembre de 2012
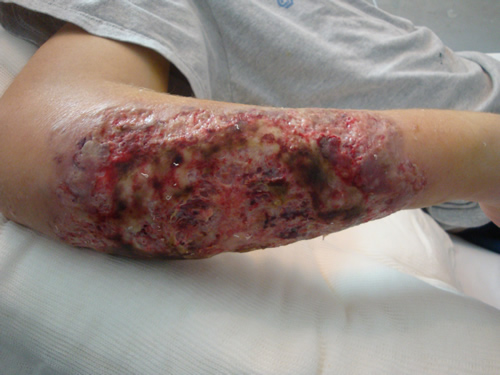
CASO CLINICO
Paciente
masculino de 21 años con diagnóstico reciente de colitis ulcerosa (dos meses
previos a la consulta), en tratamiento con mesalazina, que consulta por un
cuadro de 14 días de evolución caracterizado por lesión extensa en antebrazo
derecho, que comenzó como un nódulo que luego se ulcera, con crecimiento
progresivo, acompañado de fiebre.
Al examen físico, se encontraba
hemodinámicamente estable, febril, con palidez cutáneo mucosa
generalizada. En región póstero-externa de antebrazo derecho presentaba lesión
de 25 x 15 cm, eritémato-violácea, de bordes netos, serpinginosos,
sobreelevados, con áreas ulceradas y necróticas, rodeado de halo eritematoso
con aumento de la temperatura y dolor. En segundo dedo de mano homolateral se
observaba lesión de 3 x 2 cm de similares características. El resto de examen
físico no presentaba particularidades.
Laboratorio: hematócrito 25%,
hemoglobina 7,7g/dl, leucocitos 12000/mm3, lactato deshidrogenasa 541mUI/ml,
eritrosedimentación 120 mm/hora, resto normal.
Radiografía de antebrazo derecho: pérdida de sustancia de partes blandas, sin gas ni lesiones osteolíticas.
Se tomaron hemocultivos periféricos, cultivo local de lesión cutánea y se inició tratamiento antibiótico empírico. Se realizó toma de biopsia de la lesión cutánea.
Diagnósticos
presuntivos:
1. Leishmaniasis muco-cutánea
2. Leucemia Cutis
3. Pioderma Gangrenoso
4. Poliarteritis Nodosa
5. Celulitis Necrosante
¿Cuál es
su diagnostico? 1. Leishmaniasis muco-cutánea
2. Leucemia Cutis
3. Pioderma Gangrenoso
4. Poliarteritis Nodosa
5. Celulitis Necrosante
jueves, 20 de septiembre de 2012
HISTORIA CLINICA ORIENTADA POR PROBLEMAS (PARTE IV)
3. Plan Inicial
Para cada problema priorizado en la primera consulta es necesario establecer un plan inicial de manejo. A diferencia de la historia clínica tradicional cuyos planes muestran diversas impresiones diagnósticas seguidas por los exámenes auxiliares a solicitarse y los tratamientos a prescribirse; en la HCOP, esta sección despliega una planificación sistematizada del abordaje de cada problema. Para ello se emplea una estructura que ayuda a evitar omisiones y a transparentar la lógica de las acciones.
Para cada problema priorizado en la primera consulta es necesario establecer un plan inicial de manejo. A diferencia de la historia clínica tradicional cuyos planes muestran diversas impresiones diagnósticas seguidas por los exámenes auxiliares a solicitarse y los tratamientos a prescribirse; en la HCOP, esta sección despliega una planificación sistematizada del abordaje de cada problema. Para ello se emplea una estructura que ayuda a evitar omisiones y a transparentar la lógica de las acciones.
Sus componentes son: Plan
diagnóstico, Plan terapéutico, Plan de seguimiento y Plan de educación.
Plan Diagnóstico
Programa el uso de medios diagnósticos considerados necesarios para aclarar el origen de un problema. Este plan incluye tanto la información a ser recogida en un posterior interrogatorio, exámenes de laboratorio o complementarios, imágenes de diferentes tipos, etc.
Plan Terapéutico
Registra las indicaciones terapéuticas orientadas a favorecer la solución del problema. Ello incluye tanto el tratamiento farmacológico, como las recomendaciones dietéticas, de cambios de estilos de vida, de terapias complementarias, y otras recomendaciones farmacológicas relevantes.
Plan de Seguimiento o Monitoreo
Selecciona diversos indicadores, los cuales deben ser medidos regularmente o requeridos de manera seriada para controlar la evolución de cada problema. Ello incorpora elementos, como el peso o exámenes auxiliares, como aspectos del auto-monitoreo y auto-cuidado del paciente, tales como la medida de glicemia capilar, o un diario de síntomas. Lo importante es que sean válidos para mostrar la tendencia del problema.
Los parámetros para seguimiento, idealmente deben ser confiable y de costo asequible, estableciéndose anticipadamente la frecuencia con la que será evaluado y el nivel en que alerte la toma de decisión. Pueden usarse hojas de flujo cuando es relevante.
Plan Educativo
Breve descripción de la información que el paciente debe recibir acerca de su enfermedad, manejo y pronóstico. En el caso de programas educativos estructurados puede colocarse el nombre del paquete seleccionado.
Recuerde que:
Plan Diagnóstico
Programa el uso de medios diagnósticos considerados necesarios para aclarar el origen de un problema. Este plan incluye tanto la información a ser recogida en un posterior interrogatorio, exámenes de laboratorio o complementarios, imágenes de diferentes tipos, etc.
Plan Terapéutico
Registra las indicaciones terapéuticas orientadas a favorecer la solución del problema. Ello incluye tanto el tratamiento farmacológico, como las recomendaciones dietéticas, de cambios de estilos de vida, de terapias complementarias, y otras recomendaciones farmacológicas relevantes.
Plan de Seguimiento o Monitoreo
Selecciona diversos indicadores, los cuales deben ser medidos regularmente o requeridos de manera seriada para controlar la evolución de cada problema. Ello incorpora elementos, como el peso o exámenes auxiliares, como aspectos del auto-monitoreo y auto-cuidado del paciente, tales como la medida de glicemia capilar, o un diario de síntomas. Lo importante es que sean válidos para mostrar la tendencia del problema.
Los parámetros para seguimiento, idealmente deben ser confiable y de costo asequible, estableciéndose anticipadamente la frecuencia con la que será evaluado y el nivel en que alerte la toma de decisión. Pueden usarse hojas de flujo cuando es relevante.
Plan Educativo
Breve descripción de la información que el paciente debe recibir acerca de su enfermedad, manejo y pronóstico. En el caso de programas educativos estructurados puede colocarse el nombre del paquete seleccionado.
Recuerde que:
- El manejo
por problemas nos confiere una visión más amplia del paciente que la
aportada por el motivo de consulta, abarcando además otros problemas
importantes para su salud. Paradójicamente a su aspecto aparentemente
analítico en vez de sintético, los problemas son una guía para el manejo
integral y no fragmentado del paciente.
- El manejo
por problemas nos recuerda la necesidad del cuidado del paciente como un
TODO, y no solo del problema actual. La suma de los problemas del paciente
es lo que lo hace único.
4. Notas de Evolución
Una característica central de las notas de evolución en la HCOP, es que ellas sólo se evolucionan los problemas priorizados para cada consulta realizada, aunque puede registrarse una apreciación general del paciente.
Así, toda nota de evolución de la HCOP debe estar encabezada por el nombre y/o el número o letra del problema y se divide en 4 secciones que forman el acrónimo SOAP: subjetivo, objetivo, apreciación y plan.
SUBJETIVO: Información cualitativa referente a los síntomas del paciente, e impresiones del médico o del paciente sobre la evolución de los síntomas. Es importante registrar las tendencias de mejoría o empeoramiento, cambios en el nivel de funcionalidad, aparición de indicativos de complicaciones, nivel de adherencia y resultados de la terapéutica percibidas, entre otros puntos de la evolución.
OBJETIVO: Información objetiva. Registra los signos del paciente, datos positivos del examen físico y exámenes auxiliares, al igual que datos negativos importantes.
APRECIACIÓN: Interpretación y reevaluación del problema en función de las secciones previas. Debe incorporar la percepción del cumplimiento del plan por el paciente y el equipo de salud. Cuando se ha acumulado suficiente información para reformular el rótulo de un problema hacia una denominación más precisa, el cambio de denominación debe quedar registrado en esta sección, y también en la columna de comentarios de la lista de problemas.
PLAN: Se explicitan modificaciones en los planes iniciales, los cuales se van reajustando de acuerdo a los hallazgos encontrados hasta ese momento. Debe especificarse en cuales de las secciones del plan se enfocaran los nuevos cursos de acción.
Una característica central de las notas de evolución en la HCOP, es que ellas sólo se evolucionan los problemas priorizados para cada consulta realizada, aunque puede registrarse una apreciación general del paciente.
Así, toda nota de evolución de la HCOP debe estar encabezada por el nombre y/o el número o letra del problema y se divide en 4 secciones que forman el acrónimo SOAP: subjetivo, objetivo, apreciación y plan.
SUBJETIVO: Información cualitativa referente a los síntomas del paciente, e impresiones del médico o del paciente sobre la evolución de los síntomas. Es importante registrar las tendencias de mejoría o empeoramiento, cambios en el nivel de funcionalidad, aparición de indicativos de complicaciones, nivel de adherencia y resultados de la terapéutica percibidas, entre otros puntos de la evolución.
OBJETIVO: Información objetiva. Registra los signos del paciente, datos positivos del examen físico y exámenes auxiliares, al igual que datos negativos importantes.
APRECIACIÓN: Interpretación y reevaluación del problema en función de las secciones previas. Debe incorporar la percepción del cumplimiento del plan por el paciente y el equipo de salud. Cuando se ha acumulado suficiente información para reformular el rótulo de un problema hacia una denominación más precisa, el cambio de denominación debe quedar registrado en esta sección, y también en la columna de comentarios de la lista de problemas.
PLAN: Se explicitan modificaciones en los planes iniciales, los cuales se van reajustando de acuerdo a los hallazgos encontrados hasta ese momento. Debe especificarse en cuales de las secciones del plan se enfocaran los nuevos cursos de acción.
miércoles, 19 de septiembre de 2012
HISTORIA ORIENTADA POR PROBLEMAS (PARTE III)
1. Base de Datos
La Base de datos es comparable a una fotografía del estado del paciente al iniciar la historia clínica, tanto con respecto a los antecedentes como a los problemas médicos vigentes. Es el primer escalón para el desarrollo de la lista de problemas.
La base de datos incluye información de rutina e información específica del problema, incluye la identificación del paciente, motivo de consulta y enfermedad actual, antecedentes personales, familiares y hábitos psicobiologicos del paciente, Perfil social del paciente: Ingresos, estatus socioeconómico, vivienda. Perfil familiar del paciente: Familiograma, estructura y funcionalidad familiar, crisis familiares. Examen funcional por sistema, datos de rutina del examen físico, resultados de exámenes paraclinicos, imágenes diagnósticas, etc.
La Base de datos es comparable a una fotografía del estado del paciente al iniciar la historia clínica, tanto con respecto a los antecedentes como a los problemas médicos vigentes. Es el primer escalón para el desarrollo de la lista de problemas.
La base de datos incluye información de rutina e información específica del problema, incluye la identificación del paciente, motivo de consulta y enfermedad actual, antecedentes personales, familiares y hábitos psicobiologicos del paciente, Perfil social del paciente: Ingresos, estatus socioeconómico, vivienda. Perfil familiar del paciente: Familiograma, estructura y funcionalidad familiar, crisis familiares. Examen funcional por sistema, datos de rutina del examen físico, resultados de exámenes paraclinicos, imágenes diagnósticas, etc.
2. Lista de problemas
La lista de problemas funciona como un índice de contenidos de la HCOP. Suele ubicarse en la primera página y constituye un resumen de todas las necesidades de salud de la persona.
Incluye sólo aspectos sustentados en la base de datos, historia familiar y notas de evolución. Además, dado que la lista busca compilar los problemas más significativos del paciente, ningún aspecto de la HCOP suficientemente relevante como para ser un problema, debería ser omitido. Todos los problemas son registrados, numerados y fechados según el orden cronológico de aparición. Si un problema se resuelve o se convierte en otro, se anota la fecha de resolución.
Existen diversas maneras de elaborar la lista de problemas. En la forma más sencilla se consigna la fecha de registro y la actividad o inactividad del problema; mientras que en modelos más complejos los problemas se clasifican en agudos, crónicos, activos e inactivos, indicando su fecha de inicio, fecha de registro, fecha de fin y comentarios. Algunos modelos consideran también espacios para consignar a los factores de riesgo y alergias en la lista de problemas.
Los profesionales deben decidir los aspectos más importantes de su práctica, y en función a ello adoptar el modelo de lista de problemas más acorde a sus necesidades.
La lista de problemas funciona como un índice de contenidos de la HCOP. Suele ubicarse en la primera página y constituye un resumen de todas las necesidades de salud de la persona.
Incluye sólo aspectos sustentados en la base de datos, historia familiar y notas de evolución. Además, dado que la lista busca compilar los problemas más significativos del paciente, ningún aspecto de la HCOP suficientemente relevante como para ser un problema, debería ser omitido. Todos los problemas son registrados, numerados y fechados según el orden cronológico de aparición. Si un problema se resuelve o se convierte en otro, se anota la fecha de resolución.
Existen diversas maneras de elaborar la lista de problemas. En la forma más sencilla se consigna la fecha de registro y la actividad o inactividad del problema; mientras que en modelos más complejos los problemas se clasifican en agudos, crónicos, activos e inactivos, indicando su fecha de inicio, fecha de registro, fecha de fin y comentarios. Algunos modelos consideran también espacios para consignar a los factores de riesgo y alergias en la lista de problemas.
Los profesionales deben decidir los aspectos más importantes de su práctica, y en función a ello adoptar el modelo de lista de problemas más acorde a sus necesidades.
lunes, 17 de septiembre de 2012
HISTORIA ORIENTADA POR PROBLEMAS (PARTE II)
Registro de problemas
El registro debe reflejar lo realmente conocido del problema al momento de anotarlo. Por ejemplo, en una primera consulta, el paciente refiere palpitaciones, el problema puede ser registrado como “palpitaciones”, se comprueba por clínica la presencia de aumento de la frecuencia cardiaca, por lo que se puede definir el problema como “taquicardia”, y finalmente al realizar estudios básicos como un ECG, Holter de arritmia y/o pruebas electrofisiologicas, actualizarse como “taquicardia aurículo ventricular nodal por reentrada”. El enunciado será correcto en todos los casos, siempre que refleje el estadio diagnóstico en el que se encuentre el problema, en el momento que estamos evaluando al paciente.
Igualmente los problemas pueden ser registrados de manera agregada o desagregada,así, dos o tres condiciones pueden registrarse conjuntamente si el plan subsiguiente será el mismo para ellos. Por el contrario, si un signo o síntoma requerirá una investigación o abordaje específico, es mejor consignarlo separadamente.
El registro debe reflejar lo realmente conocido del problema al momento de anotarlo. Por ejemplo, en una primera consulta, el paciente refiere palpitaciones, el problema puede ser registrado como “palpitaciones”, se comprueba por clínica la presencia de aumento de la frecuencia cardiaca, por lo que se puede definir el problema como “taquicardia”, y finalmente al realizar estudios básicos como un ECG, Holter de arritmia y/o pruebas electrofisiologicas, actualizarse como “taquicardia aurículo ventricular nodal por reentrada”. El enunciado será correcto en todos los casos, siempre que refleje el estadio diagnóstico en el que se encuentre el problema, en el momento que estamos evaluando al paciente.
Igualmente los problemas pueden ser registrados de manera agregada o desagregada,así, dos o tres condiciones pueden registrarse conjuntamente si el plan subsiguiente será el mismo para ellos. Por el contrario, si un signo o síntoma requerirá una investigación o abordaje específico, es mejor consignarlo separadamente.
Clasificación de Problemas
Los problemas se clasifican según su aparición, duración o registro, pudiendo ser:
Según su duración
Crónicos: Problemas pre-existentes. Un ejemplo es el diagnóstico inicial de Diabetes Mellitus, que independientemente de la rapidez de su aparición, se registrará como problema crónico, pues se espera que persista.
También deben incluirse en esta categoría a factores de riesgo que requerirán un cuidado prolongado para su diagnóstico o abordaje. Un ejemplo es el sedentarismo.
Agudos: Son problemas de curso reconocidamente corto. Un ejemplo son las infecciones respiratorias altas.
Según su vigencia
Activos: Son problemas que requieren un plan de trabajo a ser desarrollado inmediatamente.
Inactivos: Son problemas que ya se solucionaron o que no requieren un plan de trabajo específico. Incluye situaciones pasadas sin manifestaciones inmediatas de actividad pero que pueden activarse en el futuro, tales como los registros de alergia. También incluye problemas recurrentes en fase de remisión, como la ulcera péptica, e igualmente los antecedentes familiares de importancia como el cáncer en familiares cercanos.
Resueltos: Son problemas que habitualmente se presentan sólo una vez y han logrado su resolución definitiva. Un ejemplo es la colecistitis resuelta con una colecistectomía.
Los problemas se clasifican según su aparición, duración o registro, pudiendo ser:
Según su duración
Crónicos: Problemas pre-existentes. Un ejemplo es el diagnóstico inicial de Diabetes Mellitus, que independientemente de la rapidez de su aparición, se registrará como problema crónico, pues se espera que persista.
También deben incluirse en esta categoría a factores de riesgo que requerirán un cuidado prolongado para su diagnóstico o abordaje. Un ejemplo es el sedentarismo.
Agudos: Son problemas de curso reconocidamente corto. Un ejemplo son las infecciones respiratorias altas.
Según su vigencia
Activos: Son problemas que requieren un plan de trabajo a ser desarrollado inmediatamente.
Inactivos: Son problemas que ya se solucionaron o que no requieren un plan de trabajo específico. Incluye situaciones pasadas sin manifestaciones inmediatas de actividad pero que pueden activarse en el futuro, tales como los registros de alergia. También incluye problemas recurrentes en fase de remisión, como la ulcera péptica, e igualmente los antecedentes familiares de importancia como el cáncer en familiares cercanos.
Resueltos: Son problemas que habitualmente se presentan sólo una vez y han logrado su resolución definitiva. Un ejemplo es la colecistitis resuelta con una colecistectomía.
Según su
situación
La priorización de problemas puede emplear criterios como:
a) el problema amenaza potencialmente la vida o puede causar una discapacidad seria (Por Ej. Fiebre prolongada y recurrente de origen desconocido).
b) el problema es uno de los motivos de consulta.
La priorización de problemas puede emplear criterios como:
a) el problema amenaza potencialmente la vida o puede causar una discapacidad seria (Por Ej. Fiebre prolongada y recurrente de origen desconocido).
b) el problema es uno de los motivos de consulta.
c) el problema,
aunque el paciente no lo identifique, es causa subyacente de otros problemas
(Por Ej. Síntomas depresivos).
Estructura de la Historia Clínica Orientada por Problemas
La HCOP está estructurada en cuatro
partes:
1.
Base de datos
del paciente
2.
Lista de
problemas
3.
Plan Inicial
4.
Notas de
evolución
Suscribirse a:
Entradas (Atom)



.png)
.png)
.png)